癌症是全球第二大疾病死因,随着人口的老龄化加剧,全球的癌症发病率和死亡率也在不断增长。不仅如此,在可预见的未来,癌症很可能成为21世纪人类死亡的首要原因,并且将是世界各国提高预期寿命的最大障碍。
值得一提的是,虽然“癌症”一词涵盖了在病程和发病率上有显著差异的各种疾病,但所有的癌症都有一个共同特征——与正常细胞不同,癌细胞以一种不受控制的方式繁殖扩散。而这一共同特征又是由癌细胞积累大量的DNA突变造成的。
2020年12月3日,德国慕尼黑大学医学院的研究人员在 Cell 子刊 Molecular Cell 杂志上发表题为:The Oncogenic Helicase ALC1 Regulates PARP Inhibitor Potency by Trapping PARP2 at DNA Breaks 的研究论文。
这项研究确定了一种对DNA修复至关重要的酶——ALC1,当癌细胞积累DNA损伤时,这种酶的缺失会导致细胞死亡。因此,针对这一DNA修复酶的化学抑制,能够诱导癌细胞“自杀”,为治疗特定癌症提供了一种新的可能。

肿瘤细胞比许多其他类型的细胞分裂更快,因此,积极促进DNA损伤的化合物常常被用作癌症的治疗药物。然而,虽然调节DNA修复的机制对细胞生存至关重要,但在治疗情况下,DNA修复系统反而是一种阻碍。
在此项研究中,研究人员瞄准了DNA修复系统的一个薄弱环节——PARPs。PAPR是一类重要的DNA修复酶,在人体中已发现18种,自2005年以来,PARPs作为癌症背景下的潜在药物靶点被越来越深入地挖掘。
其中,PARP抑制剂在乳腺癌和卵巢癌的治疗中展现出良好的疗效:在许多情况下,这些癌症缺乏功能性BRCA1或BRCA2基因——参与DNA单链修复的重要基因,这些基因的缺失迫使癌细胞使用另一种机制,而PARP酶则是这一机制的关键。
值得注意的是,虽然PARP抑制剂对特定的癌症类型十分有效,但程度不一的副作用也导致这一类药物并不适用于所有的癌症患者。
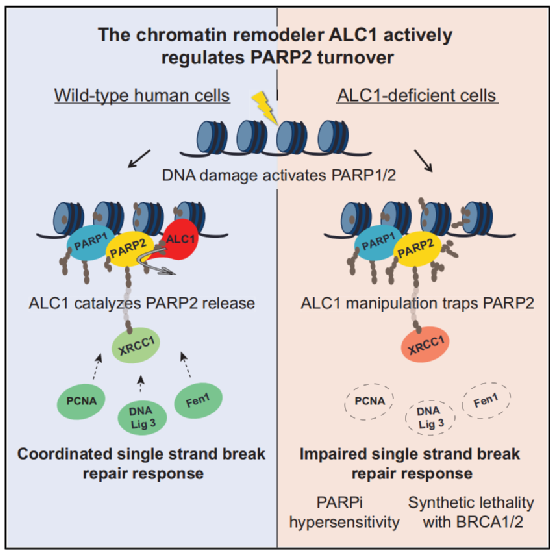
本研究的模式图
因此,研究团队试图找到除PARP以外的其他靶点。本研究的通讯作者Andreas Ladurner教授表示:“PARP1和PARP2就像喇叭一样,一旦它们与受损的DNA结合,就会发出强烈的DNA损伤信号,促进修复反应,但它们不会直接参与DNA修复的执行。”
基于这一点,研究团队试图找到PARP介导的DNA修复过程中的执行蛋白。他们发现,一种名为ALC1的酶负责专门对PARPs发出的信号作出反应。进一步实验显示,在缺乏ALC1的情况下,PARP酶仍然能与DNA受损部位结合。
这意味着,PARP2的释放需要活性的、ALC1介导的染色质重塑。
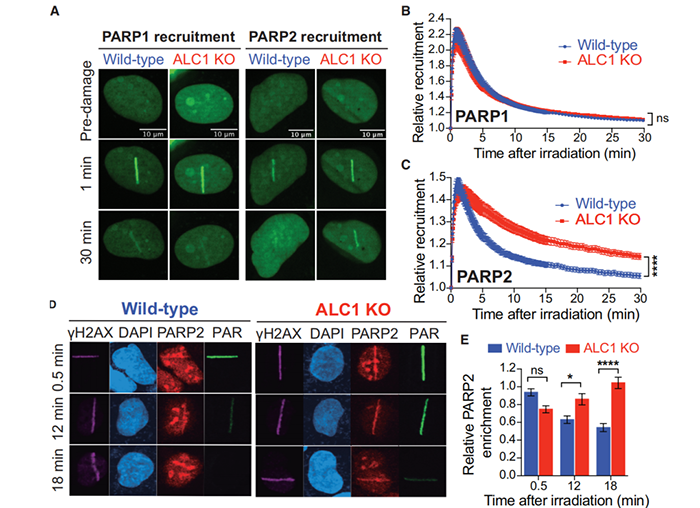
在ALC1解旋酶缺失的情况下,PARP酶仍然能与DNA受损部位结合
为了确定ALC1蛋白的具体功能,研究团队构建了功能缺失的ALC1蛋白,他们发现,失活的ALC1可以定量地捕集PARP2,但没有捕集PARP1。有趣的是,这种‘诱捕’效应可与PARPs 1和2的抑制剂引起的效应相媲美。
更重要的是,相比于PARP抑制剂,ALC1的失活更直接地使得DNA修复机制本身失效。不仅如此,事实上,ALC1功能的丧失反而增强了PARP1/2的抑制剂的作用,并介导BRCA缺陷癌症类型的联合杀伤。
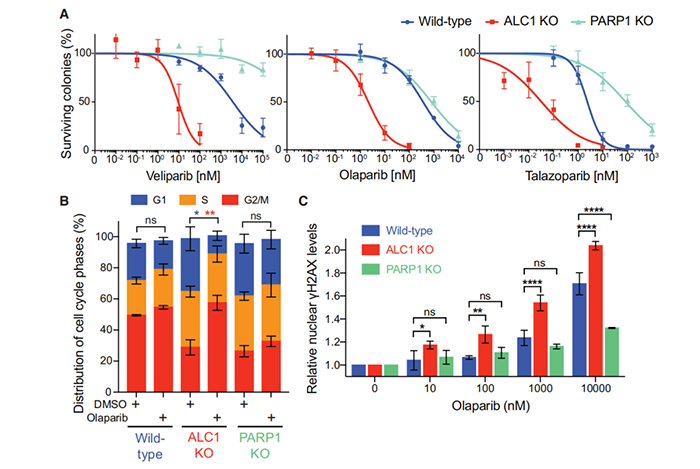
ALC1缺失增强PARPi的作用,增加DNA损伤
总而言之,这项发现提供了一种更直接的癌症治疗方法——阻断ATP推动的ALC1染色体重塑力来抑制DNA修复途径,在诱导癌细胞的死亡的同时而不破坏其他PARPs的功能。
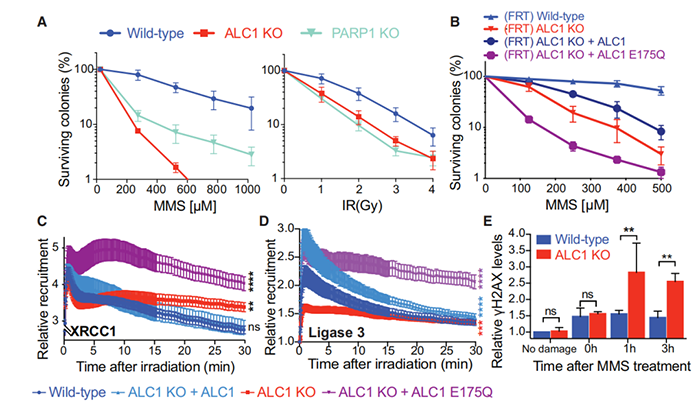
ALC1的缺失破坏了单链DNA断裂修复反应

文章来源:生物世界













